CHT352 Techniques in Drug Discovery Autumn 2020/21
Hello, dear friend, you can consult us at any time if you have any questions, add WeChat: daixieit
CHT352
Techniques in Drug Discovery
Autumn 2020/21
1. Answer ALL parts a) – d).
The structure of dihydrofolate reductase (DHFR) has been solved by X-ray crystallography and the structures of three inhibitors are reported below.
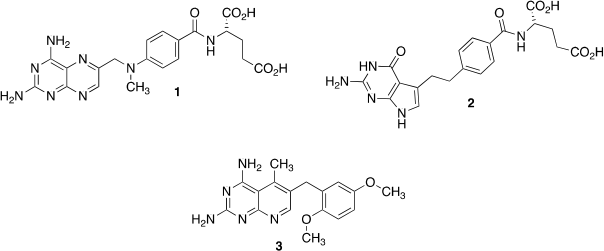
a) Hypothesise a pharmacophore from the structures above – justifying your answer and including a diagram.
b) Describe a protocol for virtual screening against DHFR of a library of 250k commercially available, generic drug-like compounds from a single provider. Include at least one ligand-based step and a structure-based step
c) Briefly discuss why the library selected for the virtual screening might not be the ideal choice.
d) Suggest an alternative structure-based method that could be used instead of the virtual screening protocol you have designed, to identify novel potential DHFR inhibitors. Discuss briefly an advantage that this method will have over your virtual screening protocol.
2. Answer ALL parts a) – e).
A series of urea derivatives were prepared as inhibitors for a matrix metalloproteinase (MMP)
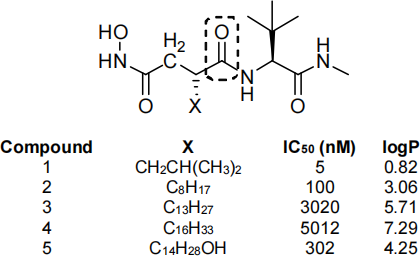
a) Rank the compounds in the order of decreasing hydrophobicity and provide a brief explanation.
b) Plot the activity against logP. Establish whether there is a linear relationship between activity and logP and comment upon its statistical validity.
c) (i) A new analogue was made by substituting X with C14H29 . At equilibrium, the organic phase (octanol) contains 7.8 x 10-2 mol·L-1 of this analogue, and the aqueous phase (water) contains 4.5 x 10-8 mol·L-1 . Calculate the logP value and explain whether it is possible to predict the IC50 value of this derivative. Give your prediction if it is possible to do so.
(ii) Provide a scenario where the mathematical equation derived from (b) cannot provide an accurate prediction of IC50 for substitution of X. Clearly explain your reasoning.
d) The carbonyl group (C=O, the circled section) is a key functional group. How would the potency be affected by replacement of the carbonyl group by a thiocarbonyl (C=S) group or a methylene (CH2) group?
e) Does compound 1 obey the Lipinski’s rule of five? Clearly provide your reasoning.
3. Answer ALL parts a) – c)
A two-electrode voltage clamp (TEVC) assay was performed on a sodium ion channel receptor using its natural messenger and the peak current measured at high ligand concentration was 483 pA. Its EC50 was determined as 500 nM.
A series of synthetic compound were then assessed as modulators of this receptor. For compound L the following data were obtained using ONLY this compound in the test solution aside from buffer. At its maximum solubility of 1 mM [A] gave a receptor current maximum of 212 pA.

a) Using the data above plot a dose-response curve graph and estimate the EC50 of compound L.
b) In the presence of 10 nM of the natural messenger molecule, the above measurements were repeated for compound L and it was found that maximum receptor current was now 612 nA.
Describe with reasoning what conclusions you can draw regarding the mode
of action of L on the receptor?
c) A compound B is now employed in the test solution of the TVEC assay both in the presence and absence of the natural messenger.
i. In the presence of B alone there is no receptor activity detected.
ii. In the presence of 100 nM B a new dose response curve is measured for the natural messenger. EC50 (apparent) is now 613 nM.
iii. At high concentrations of the natural messenger alone, the maximum current is 483 pA.
With reasoning, state the mode of action of B and describe briefly how you
would quantitatively determine its efficacy against the receptor.
2022-01-19