Enzyme Inhibition - CHEM 233L - Spring 2023
Hello, dear friend, you can consult us at any time if you have any questions, add WeChat: daixieit
Enzyme Inhibition - CHEM 233L - Spring 2023
Inhibition can be either reversible, interacting with the enzyme through non-covalent associations and dissociations, or they can be irreversible, interacting through stable, covalent bonds that cause loss of active enzyme concentration.
Reversible inhibition can be defined in various ways based upon where on the enzyme the inhibitor interacts, relative to the substrate binding site.
A competitive inhibitor interacts with the enzyme at the substrate binding site, thereby
competing with the substrate. This type of inhibition will cause a change in the
enzyme’s apparent affinity for the substrate (change in apparent KM) but will not affect the Vmax since the substrate can potentially oust the inhibitor at high enough
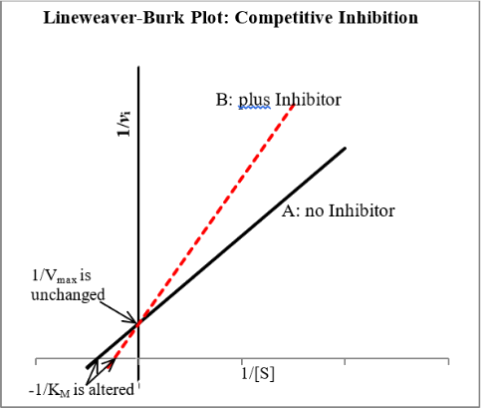
concentrations. The following plot is a double reciprocal plot (Lineweaver-Burk) of
enzymatic rates observed in the presence of a competitive inhibitor. Line A is the
Lineweaver-Burk plot of the NON-inhibited enzymatic rates observed with various
concentrations of substrate. Line B is the Lineweaver-Burk plot of the enzymatic rates observed under the same conditions however in the presence of an inhibitor. Notice how the 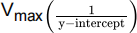 oes not change, however the
oes not change, however the 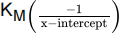 increases in the presence of the inhibitor.
increases in the presence of the inhibitor.
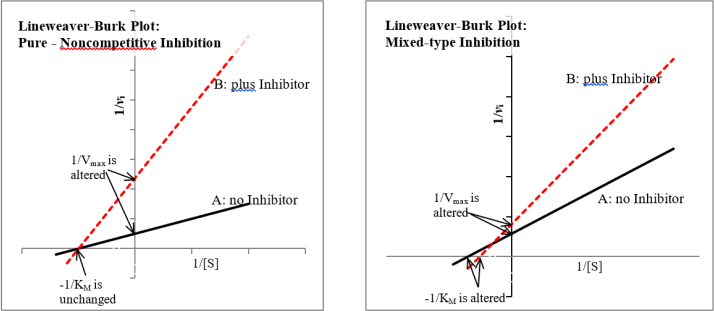
Some inhibitors interact with the enzyme at a site other than the substrate binding site. Such an event may alter the conformation of the enzyme resulting in:
1. A decrease in only the maximum catalytic rate (Vmax) of the enzyme (pure noncompetitive inhibition) or
2. A decrease in both the maximum catalytic rate (Vmax) and the apparent affinity (KM) for the substrate (mixed-typed inhibition).
The following shows an example of each inhibition:
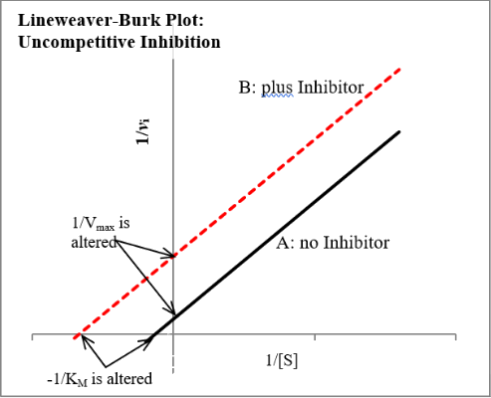
Another type of reversible inhibition occurs when the inhibitor binds only once the enzyme-substrate complex (ES) is formed. This type of inhibition is
called uncompetitive inhibition and can be easily recognized by parallel lines on a Lineweaver-Burk plot.
|
Test Your Understanding 1. A competitive inhibitor... A. inhibits by binding to the enzyme at a site other than the substrate binding site B. inhibits by binding at the substrate binding site C. inhibits by interfering in the turnover rate for the enzyme 2. An uncompetitive inhibitor... A. binds to the enzyme at the substrate binding site B. binds to the enzyme only once the substrate has bound C. binds to the enzyme before the substrate binds (Answer: 1 B. , 2 B.) |
2023-07-21