Chapter 9 Exam Pool Questions
Hello, dear friend, you can consult us at any time if you have any questions, add WeChat: daixieit
Chapter 9 Exam Pool Questions
1. In which pair do both compounds exhibit predominantly ionic bonding?
a) PCl5 and HF
b) Na2 SO3 and BH3
c) KI and O3
d) NaF and H2O
e) RbCl and CaO
2. Which one of the following has an enthalpy change that is equal to the lattice energy of MgF2?
a) MgF2(s) → Mg(s) + F2(g)
b) MgF2(s) → Mg(g) + F2(g)
c) MgF2(s) → Mg2+(g) + 2F–(g)
d) MgF2(s) → Mg(g) + 2F(g)
e) MgF2(s) → Mg2+(s) + 2F–(g)
3. In the Born–Haber cycle for NaCl(s), which of the following processes corresponds to the electron affinity of Cl?
a) Cl(g) → Cl+(g) + e–
b) NaCl(s) → Na+(g) + Cl–(g)
c) Cl2(g) → 2Cl(g)
d) Cl–(g) → Cl(g) + e–
e) Cl(g) + e– → Cl–(g)
4. Calculate the lattice energy for LiF(s) given the following:
sublimation energy for Li(s) +166 kJ/mol
∆f(H) for F(g) +77 kJ/mol
first ionization energy of Li(g) +520 . kJ/mol
electron affinity of F(g) – 328 kJ/mol
enthalpy of formation of LiF(s) – 617 kJ/mol
285 kJ/mol
–650. kJ/mol
800. kJ/mol
1052 kJ/mol
e) none of these
5. Which of the following compounds has the most ionic bonding (has the highest percentage of ionic character)?
a) LiI
b) CaF2
c) CsF
d) LiF
e) OF2
6. (W)hich of the following compounds would be expected to have the lowest melting point?
NaF
b) MgF2
c) AlF3
d) CaF2
![]() RbF
RbF
7. Atoms of an element X have the ground-state electron configuration 1s22s22p63s23p4 . What type of ion is X most likely to form?
a) X6+
b) X4+
c) X–
d) X2–
e) X3–
8. Which of the following is the Lewis dot structure for the lithium ion?
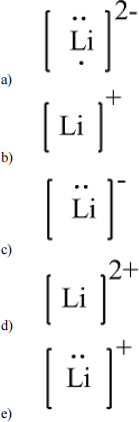
9. All of the following species have ground-state noble-gas electron configurations except
a) K+ .
b) P3– .
c) Ge4+ .
d) I– .
e) Kr.
10. The ground-state electron configuration of the Mg 2+ ion is
a) 1s22s22p6 .
b) 1s22s22p63s2 .
c) 1s22s22p63s23p2 .
d) 1s22s22p3 .
e) 1s22s22p1 .
11. What is the electron configuration for Cr2+?
a) [Ar]4s1 3d5
b) [Ar]4s2 3d2
c) [Ar]3d3
d) [Ar]4s2 3d7
e) [Ar]3d4
12. (T)he Cr2+ ion would be expected to have ____ unpaired electrons.
a) 0
b) 1
c) 2
d) 3
e) 4
13. All of the following species are isoelectronic except
a) Ca2+ .
b) Mg2+ .
Cl– .
Ar.
S2– .
14. Which pair of species is isoelectronic?
Ne and Ar
Na+ and K+
K+ and Cl–
Li+ and Ne
Be2+ and Na+
15. In which of the following lists do the ions not appear in order of increasing ionic radius?
a) Li+ < Na+ < K+
b) AI3 < Mg2+ < Na+
c) Na+ < F- < O2-
d) S2- < CI- < K+
e) CI- < Br- < I-
16. Rank the following ions in order of decreasing ionic radius: S2–, O2–, F–, Na+, Mg2+ .
a) S2–, O2–, F–, Na+ , Mg2+
b) O2–, F–, Na+ , Mg2+ , S2–
c) Mg2+ , Na+ , F–, O2–, S2–
d) Mg2+ , S2–, Na+ , F–, O2–
e) O2–, S2–, F–, Na+, Mg2+
17. A bond in which an electron pair is unequally shared by two atoms is
a) ionic.
b) polar covalent.
c) nonpolar covalent.
d) coordinate covalent.
e) metallic.
18. The measure of the attraction that an atom has for the electrons in a chemical bond is called
a) electron affinity.
b) ionization energy.
c) electronegativity.
d) resonance energy.
e) lattice energy.
19. Which of the following atoms is the most electronegative?
a) B
b) Na
c) N
d) Cs
e) AI
20. The larger the difference in electronegativity between two bonded atoms,
1. the more ionic the bond.
2. the more covalent the bond.
3. the more polar the bond.
a) 1 only
b) 2 only
c) 3 only
d) 1 and 3 only
e) 2 and 3 only
21. The Lewis formula for phosphine, PH3, has
a) four bonding pairs.
b) two bonding pairs and two lone pairs.
c) three bonding pairs and one lone pair.
d) one bonding pair and three lone pairs.
e) four lone pairs.
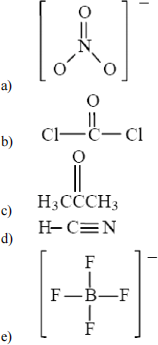
22. Which of the following Lewis formulas is incorrect?
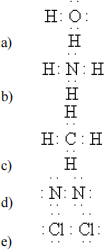
23. The Lewis structure for each of the following species except ____ contains a triple bond.
HCCH
N2
NO+
N3–
O22+
24. (H)ow many valence electrons are present in the Lewis formula for the perchlorate ion, ClO4–?
a) 30
b) 32
c) 34
d) 36
e) 36
25 . The total number of valence electrons in a superoxide ion, O2– , is
a) 1.
b) 11.
c) 12.
d) 13.
e) 14.
26. All the following statements about resonance are true except
a) A single Lewis formula does not provide an adequate representation of the bonding.
b) Resonance describes the oscillation and vibration of electrons.
c) Resonance describes a more stable situation than does any one contributing resonance formula.
d) Resonance describes the bonding as intermediate between the contributing resonance formulas.
e) The contributing resonance formulas differ only in the arrangement of the electrons.
27. In which of the following species is resonance most likely to take place?
28. For the resonance hybrid of the nitrite ion,

what is the average number of bonds between the nitrogen atom and an oxygen atom?
1
4/3
3/2
5/3
2
29. For each of the following species except ____, the electronic structure may be adequately described by two resonance formulas.
a) O3
b) SO2
c) NO2-
d) SO32-
e) C6H6
30. Which of the following are two appropriate resonance formulas for the acetate ion, CH3CO2–?
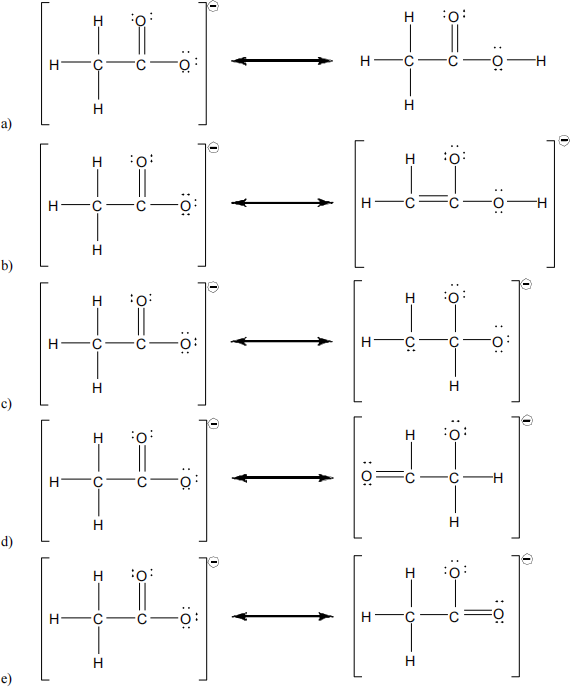
31. Which of the following species represents an exception to the octet rule?
a) CO2
b) SF4
c) SiO2
d) PCl3
e) HBr
32. The octet rule is violated by at least one atom in all the following compounds except
ClF3 .
XeF2 .
SF6 .
BF3 .
NF3 .
33. Which of the following molecules has an incorrect Lewis formula?
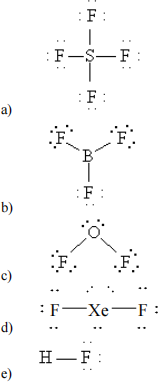
34. In the Lewis dot formula for ICl2–, the number of lone pairs of electrons around the central iodine atom is
0.
1.
2.
3.
4.
35. Which of the following Lewis structures best describes BF3? a)
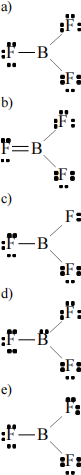
36. From a consideration of the Lewis structure of the thiocyanate ion, SCN–, in which carbon has a double bond with both the sulfur and nitrogen atoms, the formal charges on the sulfur, carbon, and nitrogen atoms
are, respectively,
a) – 1, 0, 0.
b) 0, 0, – 1.
c) – 1, +1, – 1.
d) –2, +1, 0.
e) –2, 0, +1.
37. Which of the following statements is true concerning the Lewis formula that minimizes formal charge for the sulfite ion, SO32–?
a) The formal charge of S is +6 and the formal charge of O is –2.
b) The formal charge of S is +4 and the formal charge of O is –2.
c) The formal charge of S is +2 and the formal charge of O is –2.
d) The formal charge of S is 0 and the formal charge of O is either 0 or – 1.
e) The formal charge of S is +1 and the formal charge of O is either 0 or –2.
38. Which of the following statements is true?
a) The triple bond in N2 has a larger bond order and a larger bond length than the single bond in F2 .
b) The triple bond in N2 has a larger bond order and a smaller bond length than the single bond in F2 .
c) The triple bond in N2 has a smaller bond order and a larger bond length than the single bond in F2 .
d) The triple bond in N2 has a smaller bond order and a smaller bond length than the single bond in F2 .
e) The triple bond in N2 and the single bond in F2 have the same bond order and the same bond length.
39. Which of the following diatomic molecules has the greatest bond energy?
a) CI2
b) HCI
c) CO
d) H2
e) HF
40. Using bond-energy data, what is ∆H° for the following reaction?
CH4(g) + 2F2(g) → CF4(g) + 2H2(g)
Bond Bond Energy (kJ/mol)
C-H 411
H-H 432
F-F 155
C-F 485
a) – 850 kJ
b) 850 kJ
c) 573 kJ
d) –573 kJ
e) 1483 kJ
2023-07-14