Chapter 2 Exam Pool Questions
Hello, dear friend, you can consult us at any time if you have any questions, add WeChat: daixieit
Chapter 2 Exam Pool Questions
1. Dalton’s atomic theory consisted of all the following postulates EXCEPT
a) Atoms of different elements have different properties.
b) Elements are composed of indivisible particles called atoms.
c) With gases, the volumes consumed and produced are in ratios of small whole numbers.
d) Atoms combine in fixed ratios of whole numbers.
e) In chemical changes, atoms are not destroyed, created, or changed.
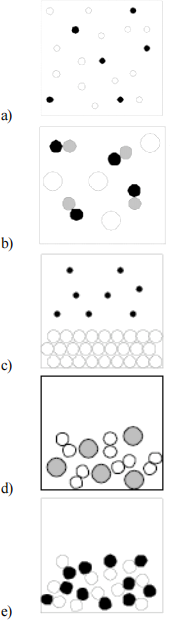
2. Which of the following pictures is a representation of a liquid mixture of two elements in which different atoms are represented by different spheres?
3. The symbol for tin is
a) Ti.
b) Tn.
c) T.
d) Sn.
e) Si.
4. Which one of the following lists gives the correct symbols for the elements phosphorus, potassium, silver, chlorine, and sulfur?
a) K, Ag, Po, Cl, S
b) P, Po, Ag, Cl, S
c) Ph, K, Ag, S, Cl
d) P, K, Ag, Cl, S
e) Ph, Po, Ag, Cl, S
5. A series of silicon–hydrogen compounds with the general formula SinH2n+2 can be represented by the known compounds SiH4, Si2H6, and Si3H8 . This best illustrates the law of
a) conservation of mass.
b) conservation of charge.
c) conservation of atoms.
d) definite composition.
e) multiple proportions.
6. Cathode rays are
a) cations.
b) electrons.
c) positrons.
d) protons.
e) anions.
7. Who discovered the electron?
a) Rutherford
b) de Broglie
c) Bohr
d) Thomson
e) Heisenberg
8. Which of the following is a correct conclusion that may be drawn from the results of Rutherford's gold foil experiments?
a) All positively charged alpha particles pass directly through gold foil.
b) Alpha particles are positively charged helium nuclei.
c) Alpha particles collide with the electrons of gold atoms, causing the atoms to become cations.
d) Some alpha particles are scattered by the nuclei of gold atoms.
e) There is negligible interaction between alpha particles and gold atoms.
9. If two different nuclides have the same atomic number, it must mean that
a) they have the same atomic mass.
b) they have the same number of protons.
c) they have the same number of neutrons.
d) they have the same number of electrons.
e) they have the same mass number.
10. How many electrons does the ion 2(5)7(9)Co2+ have?
a) 25
b) 27
c) 29
d) 32
e) 59
11. Which combination of protons, neutrons, and electrons correctly represents a 56Fe nuclide?
a) 56 protons, 26 neutrons, 26 electrons
b) 56 protons, 26 neutrons, 56 electrons
c) 26 protons, 30 neutrons, 56 electrons
d) 26 protons, 30 neutrons, 30 electrons
e) 26 protons, 30 neutrons, 26 electrons
12. There are three isotopes of carbon differing with respect to
a) neutrons.
b) atomic number.
c) nuclear charge.
d) electron configuration.
e) number of protons.
13. What is the symbol of the nuclide having 17 protons and 18 neutrons?
a) 1(3)7(5)Cl
b)
c)
d)
e)
![]() 35Ar
35Ar
17
![]() 17
17
![]() 17 Ar
17 Ar
14. The average atomic mass of Eu is 151.96 amu. There are only two naturally occurring isotopes of europium, 151Eu with a mass of 151.0 amu and 153Eu with a mass of 153.0 amu. The natural abundance of the 151Eu isotope must be approximately
20%.
40%.
50%.
60%.
80%.
15. The elements in a row of the periodic table are known as
a) a family.
b) a group.
c) metals.
d) metalloids.
e) a period.
16. Which of the following statements is not true about the element manganese?
a) It is in group VIIB (group 7).
b) It is a metal.
c) It is in period 4.
d) It tends to form anions.
e) It is a transition metal.
17. The elements in this group are termed alkali metals.
a) Group 1A
b) Group 2A
c) Group 3A
d) Group 4A
e) Group 5A
18. All of the following elements are best classified as metalloids except
B
![]() .
.
Si.
Ga.
As.
Te.
19. A sample of TNT, C7H5N3O6 , has 7.30 × 1021 nitrogen atoms. How many hydrogen atoms are there in this sample of TNT?
a) 7.30 × 1021
b) 9.73 × 1021
c) 1.22 × 1022
d) 1.46 × 1022
e) 1.70 × 1022
20. The species Na+, Mg2+, and Al3+ are all
a) anions.
b) cations.
c) isotopes.
d) isoelectronic.
e) allotropes.
21. The species that is formed when a molecule gains an electron is called
a) an anion.
b) a cation.
c) an isotope.
d) a charge mass ratio.
e) an isomer.
22. Which of the following is an ionic compound?
a) CH3OH
b) HOClO
c) NH4CN
d) NH3
e) N2O3
23. Which statement is incorrect concerning the formation of ionic compounds?
a) Metals tend to form cations, while nonmetals tend to form anions.
b) Alkali metals tend to form cations with a charge of +1.
c) Transition metals tend to form cations with a charge of +3.
d) Halogens tend to form anions with a charge of – 1.
e) Noble gases tend not to form ionic compounds.
24. The empirical formula of a salt consisting of Ca2+ and Cl– ions is
a) CaCl.
b) Ca2Cl3 .
c) CaCl2 .
d) Ca2+Cl– .
e) Ca2Cl.
25 Which of the following molecules contains the ether functional group?
a) CH3CH2 OCH2 CH3
b) CH3CH2 OH
c) H2O
d) CH3CH2 COOH
e) CH3CH2NH2
26 Which of the following molecules contains the alcohol functional group?
a) CH4
b) CH3OCH3
c) CH3OH
d) C6H6
e) C2H2
27. Which of the following statements is false?
a) A potassium ion has a total of 18 e– .
b) A sulfide ion has a total of 18 e– .
c) A sodium atom is most likely to ionize to form a cation of charge + 1.
d) The charge on a neutral chlorine atom is zero.
e) A crystal of calcium fluoride has equal numbers of calcium ions and fluoride ions.
28. Which of the following represents a commonly known ion?
![]() a)
a)
b)
c)
d)
e)
29. The formulas of the nitrite, phosphate, and nitrate ions are represented, respectively, as
a) NO2–, PO43–, NO3– .
b) N3–, PO33–, NO3– .
c) NO–, P5–, NO3– .
d) NO2–, P3–, NO3– .
e) NO3–, PO2–, N3– .
30. The correct formula for gallium oxide is
a) GaO.
b) Ga2O.
c) GaO2 .
d) Ga2O3 .
e) Ga3O2 .
31. What is the subscript of potassium in the formula for potassium sulfide?
a) 1
b) 2
c) 3
d) 4
e) 5
32. The oxoanion that comes from nitric acid is
a) NO– .
b) NO3– .
c) NO2– .
d) N2O3– .
e) HNO3– .
![]()
33. For the following balanced chemical equation, which substance represents the catalyst? 2CO(g) + 2NO(g) —![]() s—)" 2CO2(g) + N2(g)
s—)" 2CO2(g) + N2(g)
a) CO(g)
b) NO(g)
c) Rh(s)
d) CO2(g)
e) N2(g)
34. Which is a correct balanced chemical equation corresponding to the following description of a chemical reaction?
Sulfuric acid reacts with aqueous sodium hydroxide to produce aqueous sodium sulfate and water.
a) H2 S(aq) + NaOH(aq) → NaS(aq) + H2O(l)
b) H2 SO4(aq) + 2NaOH(aq) → Na2 SO4(aq) + 2H2O(l)
c) H2 S(aq) + 2NaOH(aq) → Na2 S(aq) + 2H2O(l)
d) H2 SO4(aq) + NaOH(aq) → NaSO4(aq) + H2O(l)
e) H2 SO4(aq) + 2NaOH(aq) → Na2 S(aq) + 2H2O(l) + 2O2(g)
35. When the following equation is balanced with lowest whole-number coefficients, what is the coefficient for NO(g)?
___NH3(g) + ___O2(g) → ___NO(g) + ___H2O(g)
![]() b(a) 1
b(a) 1
![]() c) 3
c) 3
4
36. The complete combustion of hexane, C6H14, yields carbon dioxide and water: __ C6H14 + __ O2 → __ CO2 + __ H2O
The smallest whole-number coefficient of oxygen in the balanced equation is
a) 16.
![]() b)
b)
c) 18.
d)
e) 20.
37. Treatment of sodium borohydride with sulfuric acid is a convenient method for the preparation of diborane: __ NaBH4 + __ H2 SO4 → __ B2H6 + __ H2 + __Na2 SO4
When the equation is balanced, the coefficient for hydrogen is
![]() b(a) 1.
b(a) 1.
c) 3.
d)
e) 5.
38. All the following may change during a chemical reaction except
a) the total number of atoms in the system.
b) the temperature of the system.
c) the density of the system.
d) the total number of molecules in the system.
e) the total volume of the system.
39. Which one of the following equations is properly balanced?
a) NH4NO3 → 2H2O + N2
b) CH3CHO + 3O2 → 2CO2 + 2H2O
c) Sn + 4HNO3 → SnO2 + 4NO2 + 2H2O
d) 2Na2 SO4 + 3Bi(NO3)3 → Bi2(SO4)3 + 9NaNO3
e) Na2CO3 + 2H2 SO4 → Na2 SO4 + 2H2O + CO2
40. Which of the following equations is not balanced?
a) 2NaCl + Pb(NO3)2 → PbCl2 + 2NaNO3
b) Fe3O4 + 3CO → 3Fe + 3CO2
c) (NH4)2Cr2O7 → N2 + 4H2O + Cr2O3
d) 2Sb2OS2 + 10O2 → 2Sb2O5 + 4SO3
e) C12H22O11 + 12O2 → 12CO2 + 11H2O
41. The names of the elements whose symbols are Si, P, Mn, and S are, respectively,
a) silicon, potassium, manganese, and sulfur.
b) silver, phosphorus, magnesium, and sodium.
c) silicon, potassium, magnesium, and sulfur.
d) silver, potassium, manganese, and sodium.
e) silicon, phosphorus, manganese, and sulfur.
42. If two different nuclides have the same mass number, it must mean that
a) both have the same total number of protons.
b) both have the same total number of neutrons.
c) both have the same total number of protons and neutrons.
d) both have the same total number of electrons.
e) they are isotopes.
43. How many protons are there in the chromium-52 nuclide?
a) 23
b) 24
c) 28
d) 29
e) 76
44. Which element belongs to the alkali metal group?
a) lithium
b) magnesium
c) oxygen
d) fluorine
e) phosphorus
45. Which of the following is a metalloid?
a) carbon
b) oxygen
c) hydrogen
d) copper
e) silicon
46. Which of the following statements is true concerning the two nuclides 3He and 4He?
a) They have the same number of neutrons.
b) They have the same relative atomic mass.
c) They have the same mass number.
d) They have different chemical properties.
e) They are isotopes.
47. The name of the S2O32- ion is
a) persulfate.
b) sulfide.
c) thiosulfite.
d) thiosulfate.
e) sulfite.
48. The formulas of the carbonate ion, the ammonium ion, and the chlorate ion are represented, respectively, as
a) CO32–, NH2–, ClO3– .
b) CO32–, NH3+ , ClO2– .
c) CO2–, NH4+ , ClO– .
d) CO32–, NH4+ , ClO3– .
e) P3–, NH3+, ClO2– .
49. What is the formula for the chloride of ytterbium(III)?
a) Yb3Cl
b) YbCl3
c) Yb2(ClO2)3
d) Yb(ClO4)2
e) Yb(ClO3)3
50. The formula of magnesium sulfide is
a) MgS.
b) MgSO2 .
c) MgSO3 .
d) MgSO4 .
e) Mg(SO4)2 .
51. The formula for aluminum bromide is
a) AlB.
b) AlBr.
c) Al2Br3 .
d) AlBr2 .
e) AlBr3 .
![]() 52. The chemical name for the model
52. The chemical name for the model
a) nitric oxide.
b) nitrogen oxide.
c) nitrogen trioxide
d) nitrogen tetroxide.
e) dinitrogen tetroxide.
53. What is the balanced chemical equation that represents the following reaction?

a) 6H + 2N → 2NH3
b) 3H2 + N2 → 2NH3
c) 2N + 2H3 → 2H3N
d) 6H + 2N → 2N3H
e) 6H + 2N → 2HN3
54. According to the law of multiple proportions:
a) if the same two elements form two different compounds, they do so in the same ratio.
b) it is not possible for the same two elements to form more than one compound.
c) the ratio of the masses of the elements in a compound is always the same.
d) the total mass is the same after a chemical change as before the change.
e) none of these
![]()
 55. Which of the following represents a pair of isotopes?
55. Which of the following represents a pair of isotopes?
Atomic Number Mass Number
a) I II
b) I II
c) I II
d) I II
e) I II
7
8
17
17
7
8
17
18
17
18
15
15
35
37
16
17
36
37
37
37
56. Which of the following elements has the largest atomic mass?
a) fluorine
b) bismuth
c) iron
d) tantalum
e) potassium
57. Which of the following models best represents the ammonia molecule, NH3?
a)
b)
c)
d)
e) None of these could represent NH3 .
58. All the following ions have the same charge except
a) oxalate.
b) permanganate.
c) oxide.
d) peroxide.
e) monohydrogen phosphate.
59. In the following chemical equation, what is the reactant? CuSO4 · 5H2O(s) → CuO(s) + SO3(g) + 5H2O(l)
a) CuSO4(s)
b) CuSO4 · 5H2O(s)
c) CuO(s)
d) SO3(g)
e) H2O(l)
![]() 60. How many of the following statements are true concerning chemical equations?
60. How many of the following statements are true concerning chemical equations?
I. Coefficients can be fractions.
II. Subscripts can be fractions.
III. Coefficients represent the relative masses of the reactants and/or products.
IV. Changing the subscripts to balance an equation can be done only once.
V. Atoms are conserved when balancing chemical equations.
![]() b(a) 1
b(a) 1
![]() c) 3
c) 3
4
61. What is the symbol for the element phosphorus?
![]() K
K
P
Pr
Po
Pt
62. Which of the following lists gives the atomic symbols for potassium, magnesium, beryllium, and sodium?
a) P, Mn, Be, Se
b) Po, Mn, Br, Na
c) Pt, Mg, Be, Sc
d) K, Mn, Br, Na
e) K, Mg, Be, Na
63. Which of the following is not a correct name–symbol combination?
a) beryllium, Be
b) boron, B
c) cobalt, Co
d) magnesium, Mn
e) copper, Cu
64. Which of the following is the atomic symbol for the element cobalt?
a) C
b) CO
c) Co
d) co
e) All of the above
65. Which of the following pairs of compounds can be used to illustrate the law of multiple proportions?
a) NH4 and NH4Cl
b) ZnO2 and ZnCl2
c) H2O and HCl
d) NO and NO2
e) CH4 and CO2
66. Which of the following is a correct conclusion that may be drawn from the results of Rutherford's gold foil experiments?
a) All positively charged alpha particles pass directly through gold foil.
b) Alpha particles are positively charged helium nuclei.
c) Alpha particles collide with the electrons of gold atoms, causing the atoms to become cations.
d) Some alpha particles are scattered by the nuclei of gold atoms.
e) There is negligible interaction between alpha particles and gold atoms.
67. Who discovered the nucleus of an atom?
a) Rutherford
b) de Broglie
c) Bohr
d) Thomson
e) Heisenberg
68. If the Thomson model of the atom had been correct, Rutherford would have observed
a) alpha particles going through the foil with little or no deflection.
b) alpha particles greatly deflected by the metal foil.
c) alpha particles bouncing off the foil.
d) positive particles formed in the foil.
e) None of the above observations is consistent with the Thomson model of the atom.
69. Which nuclide has the same number of protons as 17(4)N ?
2023-07-10